Сероводород
Сероводород придает воде неприятный запах, приводит к развитию серобактерий и вызывает коррозию. Сероводород, преимущественно присутствующий в подземных водах, может быть минерального, органического или биологического происхождения, причем в виде растворенного газа или сульфидов. То, под каким видом проявляется сероводород, зависит от реакции pH:
при pH < 5 имеет вид H2S;
при pH > 7 выступает в виде иона HS-;
при pH = 5 ÷ 7 может быть в виде, как H2S, так и HS-.
Полное удаление Н2S аэрированием возможно лишь при подкислении воды до рН<5. В этих условиях высокая концентрация водородных ионов подавляет диссоциацию сероводорода, поэтому большая часть его будет находиться в молекулярной форме, которая легко удаляется аэрированием.
Главным источником сероводорода и сульфидов в поверхностных водах являются восстановительные процессы, протекающие при бактериальном разложении и биохимическом окислении органических веществ естественного происхождения, и веществ, поступающих в водоем со сточными водами (хозяйственно-бытовыми, предприятий пищевой, металлургической, химической промышленности, производства сульфатной целлюлозы (0,01-0,014 мг/дм3) и др.).
Особенно интенсивно процессы восстановления происходят в подземных водах и придонных слоях водоемов в условиях слабого перемешивания и дефицита кислорода. Значительные количества сероводорода и сульфидов могут поступать со сточными водами нефтеперерабатывающих заводов, с городскими сточными водами, водами производств минеральных удобрений.
Концентрация сероводорода в водах быстро уменьшается за счет окисления кислородом, растворенным в воде
Причиной ограничения концентраций в воде является высокая токсичность сероводорода, а также неприятный запах, который резко ухудшает органолептические свойства воды, делая ее непригодной для питьевого водоснабжения и других технических и хозяйственных целей. Появление сероводорода в придонных слоях служит признаком острого дефицита кислорода и развития заморных явлений.
Концентрация сероводорода обычно измеряется в мг/л. Газ может содержаться как в горячей, так и в холодной воде. Запах становится ощутимым уже при концентрации 0,5 мг/л. Обычно концентрация растворенного H2S не превышает 10 мг/л, но иногда встречаются концентрации 50 мг/л и более
Сероводород препятствует окислению духвалентного железа, присутствующего в воде.Методы удаления сероводорода
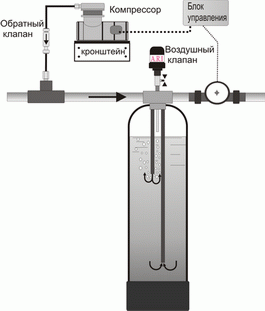
 Аэрация на безнапорном дегазаторе с принудительной подачей воздуха и дальнейшим аэрированием путём смешивания кислорода воздуха с водой путём подачи атмосферного воздуха через воду при помощи мелкопузырчатого аэратора. Одновременно вода насыщается кислородом. При этом сероводород окисляется и выветривается. К недостаткам метода можно отнести относительную громоздкость оборудования наличие «контактной ёмкости 0.5 - 3 м3 », а также энергоемкость в связи с необходимостью использовать насоса второго подъема воды.
Аэрация на безнапорном дегазаторе с принудительной подачей воздуха и дальнейшим аэрированием путём смешивания кислорода воздуха с водой путём подачи атмосферного воздуха через воду при помощи мелкопузырчатого аэратора. Одновременно вода насыщается кислородом. При этом сероводород окисляется и выветривается. К недостаткам метода можно отнести относительную громоздкость оборудования наличие «контактной ёмкости 0.5 - 3 м3 », а также энергоемкость в связи с необходимостью использовать насоса второго подъема воды.
 Аэрация напорная, производится путём принудительной подачи кислорода воздуха под давлением непосредственно в магистраль подачи холодной воды, с последующей дегазацией в напорной аэрационной колонне в целях удалениясероводорода с последующей фильтрацией на зернистой загрузке.
Аэрация напорная, производится путём принудительной подачи кислорода воздуха под давлением непосредственно в магистраль подачи холодной воды, с последующей дегазацией в напорной аэрационной колонне в целях удалениясероводорода с последующей фильтрацией на зернистой загрузке.
 Окисление с дозацией окислителя в воду с последующей фильтрацией на зернистой загрузке. Наиболее эффективно совмещение методов аэрации и химического окисления сероводорода. В качестве окислителя эффективно работают гипохлорит натрия, перекись водорода, озон. После окисления примесей, воду подают на фильтр с зернистой загрузкой. Минусом данных способов является то, что при дозации необходимо постоянное проведение анализа воды и корректировки дозации окислителя, так как вследствие сезонных колебаний состава воды окислителя будет либо слишком много, либо слишком мало
Окисление с дозацией окислителя в воду с последующей фильтрацией на зернистой загрузке. Наиболее эффективно совмещение методов аэрации и химического окисления сероводорода. В качестве окислителя эффективно работают гипохлорит натрия, перекись водорода, озон. После окисления примесей, воду подают на фильтр с зернистой загрузкой. Минусом данных способов является то, что при дозации необходимо постоянное проведение анализа воды и корректировки дозации окислителя, так как вследствие сезонных колебаний состава воды окислителя будет либо слишком много, либо слишком мало