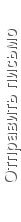Окислительно-восстановительный потенциал (редокс-потенциал, Eh)
Окислительно-восстановительный потенциал (мера химической активности) Eh вместе с рН, температурой и содержанием солей в воде характеризует состояние стабильности воды. В частности этот потенциал необходимо учитывать при определении стабильности железа в воде. Eh в природных водах колеблется в основном от -0,5 до +0,7 В, но в некоторых глубоких зонах Земной коры может достигать значений минус 0,6 В (сероводородные горячие воды) и +1,2 В (перегретые воды современного вулканизма).
Подземные воды классифицируются:
Eh > +(0,1–1,15) В
– окислительная среда; в воде присутствует растворенный кислород, Fe3+, Cu2+, Pb2+, Mo2+ и др.
Eh – 0,0 до +0,1 В
– переходная окислительно-восстановительная среда, характеризуется неустойчивым геохимическим режимом и переменным содержанием кислорода и cероводорода, а также слабым окислением и слабым восстановлением разных металлов;
Eh < 0,0
– восстановительная среда; в воде присутствуют сероводород и металлы Fe2+, Mn2+, Mo2+ и др.
Зная значения рН и Eh, можно по диаграмме Пурбэ установить существования соединений и
элементов Fe2+, Fe3+, Fe(ОН)2, Fe(ОН)3, FeСО3, FeS, (FeOH)2+.
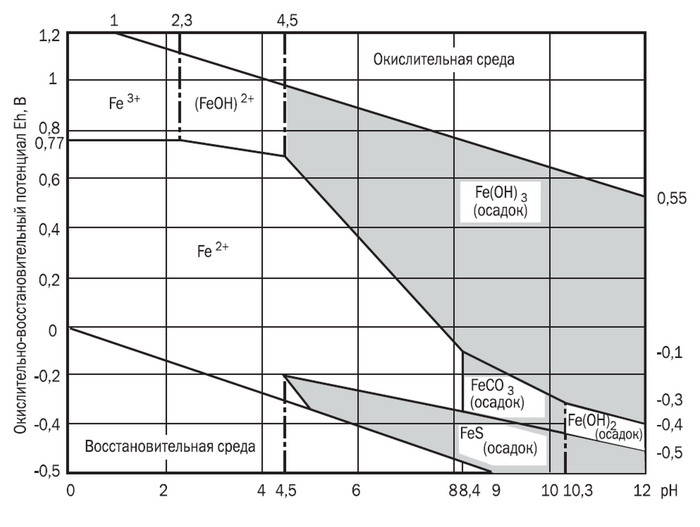
Диаграмма характеризует соотношения устойчивости между окислами и карбонатом марганца при условии, что сумма растворенной CO2 равна 10-1,4(можно считать, что вначале система была насыщена CO2 при давлении 1 атм)
Из диаграммы видно, что поле карбоната марганца (родохрозита) заметно больше поля сидерита в аналогичных условиях. В отсутствие СО2 устойчивость более высоковалентных окислов и гидроокиси марганца повышается с увеличением окислительного потенциала. Например, гидроокись марганца (пирохроит) - чрезвычайно редкий минерал: и для его образования необходима щелочная восстановительная среда и практически полное отсутствие СО2.
Как и в процессах очистки от железа, так и при деманганации предварительное осаждение оксидов марганца на поверхности зерен фильтрующей загрузки оказывает каталитическое влияние на процесс окисления двухвалентного марганца растворенным кислородом. В процессе фильтрования предварительно аэрированной и при необходимости подщелоченной воды на зернах песчаной загрузки образуется слой осадка гидроксида марганца Mn (OH)4. Ионы растворенного Mn2+ адсорбируются поверхностью гидроксида марганца и гидролизуются, образуя оксид трехвалентного марганца Mn2O3. Последний окисляется растворенным кислородом вновь до Mn (OH)4, который опять участвует в процессе каталитического окисления. Уравнения реакций этих процессов можно представить следующим образом:
Mn(OH)4 + Mn(OH)2 = Mn2O3 + 3 H2O (2)
2 Mn2O3 + 2 O2 + 8 H2O = Mn(OH)4 ↓ (3).